Ингибитор фосфодиэстеразы 4 при псориазе
Кофоед К., Сков Л., Захари К. кафедра дермато-аллергологии, Университет Копенгагена, Дания
В последние десятилетия, понимание патофизиологии псориаза изменилось. В настоящее время псориаз рассматривается как системная воспалительная болезнь с очевидной ролью иммунной системы. Это отражается в постепенном переходе от неселективных методов, таких как кортикостероиды, метотрексат, и ацитретин, к селективным методам лечения, таким как циклоспорин и высокоселективные биологические методы лечения. Внедрение ингибиторов фактора некроза опухоли (ФНО-α) в практику осуществило прорыв в терапии псориаза и изменило наше представление о патофизиологии псориаза. Достижения ингибиторов ФНО-α также отражаются в объемах их ежегодных продаж. В 2013 году наиболее отпускаемыми по рецепту лекарствами в мире были адалимумаб, этанерцепт и инфликсимаб, годовой объем продаж которых составил 10 млрд. долларов. Т.к. эти препараты также используются для лечения других воспалительных состояний, например ревматоидного артрита и болезни Крона, то общее количество больных псориазом, использовавших TNF-α ингибиторы не известно.
Еще один способ лечения псориаза нацелен на Т-клетки либо путем ингибирования связывания функции лимфоцитов – антиген-3 (LFA-3) CD2 (например, алефацепт) или с помощью блокировки цепи LFA-1 CD11a и ингибирования клеточной адгезии (например эфализумаб). Тем не менее, в Европе, алефацепт утвержден не был и эфализумаб был снят из-за серьезных побочных эффектов. Единственным крупным антипсориазным препаратом с определенной физиологической мишенью является устекинумаб (моноклональные антитела к интерлейкину-12/23). Успех устекинумаба доказал важность ИЛ-23 / T хелперов 17 (Th17) при псориазе. Несколько новых биопрепаратов, направленных на эти мишени, вероятно, достигнут клиники в ближайшие годы. В 2013г. годовой объем продаж устекинумаба достиг 1,5 миллиарда долларов США.
Биопрепараты не только дороги, но и требуют повторных инъекций и некоторые пациенты испытывают потерю терапевтического эффекта (тахифилаксия). Таким образом сегодня возникла необходимость создания пероральных, доступных по цене, низкомолекулярных ингибиторов. Несколько небольших молекул для лечения псориаза находятся в фазе испытаний. Первыми из этих препаратов, которые потенциально будут утверждены, являются ингибитор Янус-киназы (JAK) тофацитиниб (tofacitinib) и ингибитор фосфодиэстеразы апремиласт (apremilast). Среди других исследуемых малых молекул аденозин агонисты рецепторов A3 и новые противовоспалительные агенты.
В этой статье мы представим обзор новых биопрепаратов и малых молекул для лечения псориаза, находящихся в стадии разработки. Мы рассмотрим клинические испытания связанные с малыми молекулами и биопрепаратами в стадии разработки для лечения псориаза, опубликованными в рецензируемых журналах с 2011 года и наиболее значимые тезисы конференций, представленных в 2013-2014 годах. Акцент этого обзора будет сделан на механизмах действия, эффективности и побочных эффектах этих новых агентов.
IL-12 и IL-23 являются гетеродимерными плейотропными цитокинами, каждый из которых состоит из 2 субъединиц, которые названы accordingto. Субъединицы р40 с молекулярным весом 40 кДа являются общими для обоих цитокинов, в то время как второй субъединицей у IL-12 является белок р35 с весом 35 кДа, а у ИЛ-23- белок р19 с весом 19кДа. Поэтому IL-23 имеет биологическую активность, подобную ИЛ-12, и вместе с тем отличающуюся от Ил-12. IL-12 продуцируется макрофагами и В-клетками и как было показано, оказывает несколько эффектов на Т-клетки и природные клетки-киллеры (NK), в то время как IL-23 является существенным для дифференциации лимфоцитов Th17. Th17-лимфоциты участвуют в развитии псориаза с помощью производства провоспалительных цитокинов IL-17A, IL-17F, и ИЛ-22. К настоящему времени опубликованы результаты испытаний только 2 ингибиторов IL-12 и IL-23 – устекинумаба и бриакинумаба. Устекинумаб одобрен в Канаде, Европе и США для лечения умеренного до тяжелого бляшечного псориаза. В клиническом испытании III фазы бриакинумаба 82% больных на 24 неделе достигли индекса PASI75 по сравнению с 40% пациентов, получавших метотрексат. Тем не менее, озабоченность по поводу возможных неблагоприятных сердечно-сосудистых эффектов у бриукинумаба привела к прекращению его использования в США и Европе в 2011 году.
В настоящее время клинические испытания проходят несколько ингибиторов с уникальной ориентацией на p19 субъединицу IL-23. На основе расширения знаний патофизиологии псориаза эта интересная мишень выглядит многообещающе, но пока никаких результатов этих исследований в рецензируемых журналах опубликовано не было. Тем не менее, результаты исследования моноклонального антитела – IgG1 к p19, тилдракизумаба (tildrakizumab) (MK-3222), были представлены на 71-й ежегодной конференции Американской академии Дерматологии (AAD) в марте 2013 г. II фаза исследования с участием 355 пациентов с псориазом показала, что после 16 недель лечения 74% достигли PASI75 по сравнению с 4,4% в группе плацебо. Результаты исследования II фазы, в котором оценивался гузелкумаб (guselkumab) (CNTO1959), другое человеческое моноклональное антитело к p19, были представлены на 72-ом ежегодном собрании в марте 2014 года (Денвер, США). Пациенты от умеренного до тяжелого псориаза (п = 293) были рандомизированы для получения плацебо, гузелкумаба или адалимумаба. На 16 неделе значение PASI75 было достигнуто у 81% пациентов группы, получавшей 50 мг гузелкумаба, по сравнению с 71% пациентов, получавших адалимумаб и 4,8% получавших плацебо. Побочные эффекты были зарегистрированы у 66% пациентов, получавших гузелкумаб и у 72% больных, получавших адалимумаб.
Ингибиторы интерлейкина-17
Семейство IL-17 включает IL-17A, IL-17B, IL-17C, ИЛ-17D, IL-17E (также называемый ИЛ-25) и IL-17F. IL-17A ключевой провоспалительный цитокин в патогенезе псориаза. IL-17 способны активировать кератиноциты, что приводит к гиперпролиферации и в дальнейшем к производству антимикробных пептидов, цитокинов и хемокинов, которые, в свою очередь, вербуют и активируют другие иммунные клетки, ведущие к усилению воспаления при псориазе.
Несколько ингибиторов Ил-17 проходят испытания для применения при псориазе. Секукинумаб (Secukinumab) является человеческим моноклональным антителом IgG1, которое избирательно связывает и нейтрализует IL-17A. II фаза исследований показала, что через 12 недель лечения подкожными инъекциями секукинумаба при умеренном-тяжелом псориазе индекса PASI75 достигли 82% больных при 9% с плацебо. Доля достигших PASI90 через 12 недель была 52% по сравнению с 5% в группе плацебо. В целом секукинумаб переносился хорошо, но в 2 случаях развилась нейтропения. На 22-м конгрессе Европейской Ассоциация дерматологии и венерологии (EADV) в октябре 2013г. (Стамбул, Турция) были представлены результаты III фазы сравнительного секукинумаба и этанерцепта с использованием 2 режимов дозирования для определения эффективности при псориазе. Более половины (54%) пациентов, получивших лечение секукинумабом достигли PASI90 на 12 неделе по сравнению с 21% у пролеченных этанерцептом. PASI100 на 12 неделе был замечен у 24% пациентов из группы секукинумаба против 4% в группе этанерцепта. Эффективность секукинумаба была устойчивой в течении всего одногодичного наблюдения. Ответ PASI90 через 52 недели сохранялся у 65% пациентов.
Иксекизумаб (Ixekizumab) – это гуманизированное моноклональное антитело IgG4, которое также нейтрализует IL-17A. Через 12 недель лечения подкожными инъекциями иксекизумаба индекс PASI75 или PASI90 был у 82% и 71%, соответственно. Побочные эффекты наблюдались у 63% пациентов, как правило, не представлявшие серьезной опасности. Во II фазе исследования бродалумаба на 12 неделе PASI75 и PASI90 были достигнуты у 82% и 75% больных, соответственно. Наиболее типичными побочными эффектами были назофарингит (8%), инфекция верхних дыхательных путей (8%), и эритема в месте инъекции (6%). Исходя из результатов опубликованных исследований, ингибиторы Ил-17, показали быстрое положительное воздействие на пациентов с умеренным до тяжелого псориаза. На 12-й неделе лечения ответ PASI75 был достигнут, по крайней мере у 82% пациентов во всех испытаниях.
Новый препарат, представляющий собой анти-ФНО антитела называется цертолизумаб. Это полиэтиленгликоль-конъюгированный ингибитор ФНО, который в отличие от других анти-ФНО моноклональных антител (например, инфликсимаба и адалимумаба) отсутствует кристализующийся фрагмент (FC) и, следовательно, не он вызывает антитело-зависимую цитотоксичность, активацию комплемента, или апоптоз в Т-клетках или макрофагах. Снижение риска таких воспалительных явлений потенциально может сделать повторное лечение безопаснее.
Аналогично инфликсимабу и адалимумабу, цертолизумаб связывается с растворимым и мембранно-связанным ФНО-α, тем самым блокируя важные события, связанные с воспалением при псориазе. В США FDA и в Европе Европейское агентство по лекарственным средствам (EMA) одобрили цертолизумаб для лечения анкилозирующего спондилита, ревматоидного и псориатического артритов. Цертолизумаб был протестирован в исследовании II фазы с участием 176 пациентов от умеренного до тяжелого псориаза. PASI75 было достигнуто у 83% пациентов при суточной дозе 400 мг. Большинство побочных эффектов были слабыми или умеренными. Серьезные побочные эффекты наблюдались у 3% – 5%. Среди созданых ингибиторов ФНО несколько биоподобных продуктов (дженерики), вероятно, будут лицензированы в ближайшие годы. Сроки патентов на некоторые оригинальные биопрепараты истекают или уже истекли, что привело к повышенному интересу к производству дженериков биологических препаратов. В сентябре 2013 года, EMA утвержден Инфлектра (Inflectra), первый биоподобный (дженерик) инфликсимаб и биоподобный этанерцепт, CHS-0214. Несколько малых молекул находятся на испытании для лечения при псориазе, в т.ч. ингибиторы фосфодиэстеразы (PDE), ингибиторы JAK и агонисты A3 аденозин рецепторов (A3 AR). Ингибиторы фосфодиэстеразы ФДЭ-4 представляют собой фермент, который катализирует расщепление 3′-5′-циклического аденозин монофосфата (цАМФ). цАМФ, как известно, подавляет воспаление и увеличение ее концентрации, связанное с ингибированием ФДЭ-4 уменьшит продукцию провоспалительных медиаторов TNF-α и IL-23, которые активны при псориазе, и увеличит производство противовоспалительных медиаторов, таких как IL-10.
Апремиласт (аpremilast) является пероральным специфическим ингибитором ФДЭ-4, который работает внутриклеточно. Апремиласт был одобрен FDA марта 2014 для лечения взрослых с активным псориатическим артритом. Во 2 фазе многоцентрового исследования с участием пациентов с умеренным до тяжелого псориаза исследователи обнаружили, что к 16 неделе PASI75 был достигнут у 29% пациентов, получавших апремиласт по 20 мг и у 41% пациентов при приеме 30 мг 2 раза в день. 96% побочных эффектов были легкими или умеренными. Зарегистрировано 8 серьезных побочных эффектов, в т.ч. плацебо- 3случая, апремиласт 20 мг-3, апремиласт 30 мг – 2. На 71-й ежегодной встрече AAD были доложены результаты III фазы исследования оценки безопасности и эффективности перорального апремиласта.
В этом коротком исследовании, не было ни одного случая туберкулеза или лимфомы и не было роста сердечно-сосудистого риска или оппортунистических инфекций. Диарея и тошнота для апремиласта по сравнению с плацебо зарегистрирована у 18,8% и у 15,7% по сравнению с 7,1% и 6,7%, соответственно. Желудочно-кишечные побочные эффекты произошли в основном в течение первых 15 дней после первой дозы и в большинстве случаев разрешились в течение следующих 15 дней.
Ингибиторы Янус-киназ (JAKs) являются цитоплазматическими протеинтирозинкиназами, которые необходимы для инициирования активированных сигнальных путей цитокина. JAKs связаны с фосфорилированием и активацией датчика сигнала и белков активатора транскрипции (STAT). Активированные STAT белки контролируют экспрессию ядерного гена, вызывая транскрипцию провоспалительных генов. Несколько цитокинов и факторов роста действуют через через STAT белки. Есть 4 типа Jaks: JAK1, JAK2, JAK3 и TYK2. JAKs действуют в парах на интрацитоплазматической части рецептора цитокина. Каждая пара JAKs может быть активирована различными цитокинами и, в свою очередь, активировать различные белки STAT. Интерлейкины Ил-12, Ил-19, Ил-20, Ил-22, Ил-23 и ИЛ-24 работают используя JAK / STAT пути; однако, 2 ключевых цитокина при псориазе, ФНО-α и IL-17, не используют ЯК / STAT пути и, таким образом, непосредственно не мешает JAK торможению).
Тофациниб является ингибитором JAK1 и JAK3 сигнальных путей. Тофациниб одобрен для лечение ревматоидного артрита в США, но не в Европе. Тофациниб в настоящее время изучен при лечении псориаза, воспалительного заболевания кишечника и других иммунологических заболеваниях. На 12-й неделе PASI75 был достигнут у 67% пациентов, получавших 15 мг в день тофациниба. Тофациниб как правило, хорошо переносится, но сообщалось о некоторых побочных эффектах. Наиболее часто сообщали об инфекции (назофарингит, синусит, инфекции верхних дыхательных путей. Также наблюдались дозозависимое повышение в сыворотке липопротеинов высокой и низкой плотности, а также общего холестерина, снижение гемоглобина, гематокрита, и эритроцитов в крови. В последнее время представлены результаты фаза III исследования 1101 пациента с умеренным или тяжелым псориазом, которые были рандомизированы на тофациниб, этанерцепт и плацебо. К 12-й неделе PASI75 наблюдался у 64% пациентов в группе, получавшей тофациниб по 10 мг 2 раза в день по сравнению с 59% в группе этанерцепта и 5,6% в группе плацебо. Два разных небольших, многоцентровых исследования были посвящены местному применению 2% мази тофациниба. Мазь наносилась 2 раза в день в течение 4 недель. К 4-й неделе продемонстрировано статистически значимое улучшение на 54,4%.
Другой ингибитор JAK, руксолитиниб (ruxolitinib), был первоначально разработан для системного лечения миелопролиферативных расстройств. Руксолитиниб избирательно ингибирует JAK1 и JAK2. В последнее время для местного применения были разработаны 0,5%, 1%, и 1,5% руксолитиниб. У пациентов со стабильным бляшечным псориазом использование мази руксолитиниба 1- 2 раза в день в течение 28 дней привело к уменьшению поражения (площадь плюс покраснение плюс толщина) на 53% и на 54% при концентрациях мази 1% и 1,5%, соответственно, по сравнению с 32% для транспортного средства. Местное применение было хорошо переносимым при нескольких слабых побочных эффектах. Агонисты рецепторов A3 АР участвуют в различных внутриклеточных сигнальных путях и ряде физиологических функций. Ориентация на A3 AR для борьбы с воспалением основана на двух выводах. Во-первых, A3 АР высоко выражены в мононуклеарных клетках периферической крови, выделенных от пациентов с псориазом. Во-вторых, A3 Активация AR с конкретным агонистом (CF101) подавляет фактор-kB ядерного сигнального пути, ингибирует распространение специфических аутореактивных Т-лимфоцитов, а также индуцирует апоптоз в воспалительных клетках. Эти эффекты приводят к понижающей регуляции провоспалительных цитокинов, таких как TNF-α, IL-6, и IL-12. В фазе II, многоцентрового исследования, 75 пациентов с умеренным и тяжелым псориазом принимали внутрь CF101 (1 мг, 2 мг, или 4 мг) или плацебо вводили перорально два раза в день в течение 12 недели. В 2 мг CF101-группе 35,3% пациентов достигли PASI50 ответа. Побочные эффекты при приеме CF101 были легкими. Только 4 пациента были исключены из исследования в связи с побочными эффектами, в т.ч. один пациент в группе плацебо. На основе исследований, опубликованных до настоящего времени, малые молекулы не будут обладать такой же эффективностью, как биопрепараты, однако, они обладают некоторыми важными преимуществами. Они перорально доступны или могут быть даже использованы в качестве местных препаратов, они дешевле в производстве, и они могут представлять важные новые знания о патофизиологии псориаза.
ОБСУЖДЕНИЕ
Несколько новых препаратов, воздействующих на разные внеклеточные и внутриклеточные иммунные процессы, находятся на испытании для лечения псориаза. Некоторые из этих новых лекарств продемонстрировали отличные клинические эффекты в испытаниях, даже если смотреть на ответ PASI90. Ожидается несколько новых вариантов для лечения псориаза в ближайшие годы, однако, очевидно, что эти испытания не были достаточно продолжительными или достаточно широкоохватываемыми, чтобы выяснить любые необычные побочные эффекты. Предстоящая 3 фаза испытаний даст новую важную информацию, но даже эти испытания не будут в состоянии идентифицировать редкие побочные эффекты или выяснить долгосрочную безопасность, как показывает опыт с эфализумабом. Основываясь на исследованиях 2700 пациентов, эфализумаб был одобрен для лечения умеренного и тяжелого псориаза в 2003 г. В 2009 году было зарегистрировано 3 случая спонтанной прогрессивной мультифокальной лейкоэнцефалопатии (PML) и 1 случай с подозрением на нее. После этого эфализумабом пролечено более чем 46000 пациентов подвергались без выявления PML. Потому что PML относится к очень редким, крайне маловероятным побочным эффектами в первую очередь развивается у лиц с ослабленным иммунитетом. Тщательный мониторинг и крупные клинические реестры есть и будут важными инструментами для обнаружения этих редких нежелательных эффектов. Следует учитывать, что терапия новыми препаратами оценивается в клинически сложных группах пациентов с псориазом, таких как пациенты с сопутствующими заболеваниями, что не учитывается в большинстве исследований. Кроме того, исследования не учитывают различные подтипы псориаза, генетический фон и поведение биомаркеров, что было бы желательно. Другой недостаток – краткосрочный характер большинства клинических исследований, при которых отсутствует информация о склонности новых моноклональных антител индуцировать ответные антитела, которые могут ограничить их долгосрочную эффективность. Однако, есть несколько других препараты для лечения псориаза с еще неопубликованными клиническими исследованиями. таких, как агонист рецепторов 1 селективного сфингозина 1-фосфат, понесимод (ponesimod), который защищает от лимфоцитарно-опосредованного воспаления тканей.
Заключение
Вероятно в ближайшие годы в лечении псориаза появятся несколько новых, эффективных терапевтических возможностей. Эти новые методы лечения помогают нам лучше понять патофизиологию псориаза. Тем не менее, мы должны быть в курсе всех ограничений лекарственных средств при выборе лечения, поэтому, тщательный мониторинг и большие клинические реестры все еще остаются важными инструментами в лечении пациентов.
Источник
Апремиласт, ингибирующий фосфодиэстеразу 4 типа и подавляющий синтез различных провоспалительных цитокинов, – это низкомолекулярный базисный противовоспалительный препарат таргетного действия, предназначенный для лечения средне-тяжелого и тяжелого бляшечного псориаза и активного псориатического артрита (ПсА). В рандомизированных, плацебо-контролируемых исследованиях 3 фазы, проводившихся в целом у нескольких тысяч больных псориазом (ESTEEM 1, 2) и ПсА (PALACE 1-3, ACTIVE), апремиласт по эффективности достоверно превосходил плацебо. Апремиласт не является белком и, соответственно, не обладает иммуногенностью. В клинических исследованиях апремиласт характеризовался благоприятным профилем безопасности, в частности не вызывал увеличения риска инфекционных осложнений.
Оглавление
Псориаз – это хроническое иммуновоспалительное заболевание кожи, распространенность которого в общей популяции достигает 2% [1]. В настоящее время псориаз рассматривают как системное заболевание, поражающее не только кожу, но и другие ткани, в частности суставы и ногти [2]. Псориатический артрит (ПсА) развивается примерно у каждого третьего больного псориазом и может сопровождаться воспалением энтезисов (энтезит) и сухожилий пальцев кистей и стоп (дактилит, теносиновит), тел позвонков (спондилит) и илиосакральных сочленений (сакроилиит) [3,4]. Для лечения средне-тяжелого и тяжелого бляшечного псориаза и ПсА применяют различные базисные противовоспалительные препараты (БПВП), прежде всего метотрексат, и генно-инженерные биологические препараты (ГИБП), в том числе ингибиторы фактора некроза опухоли-α (ФНО-α), интерлейкинов-12/23 (ИЛ-12/23) и ИЛ-17А, которые оказывают действие на все проявления псориатической болезни [5,6].
Апремиласт – это таблетированный представитель низкомолекулярных БПВП таргетного действия для лечения псориаза и ПсА [7]. Апремиласт оказывает селективное ингибирующее действие на фосфодиэстеразу 4 типа (ФДЭ 4), которая разрушает цикло-аденозинмонофосфат (цАМФ) [8]. Увеличение содержания цАМФ в клетках, экспрессирующих ФДЭ 4, сопровождается подавлением синтеза провоспа лительных цитокинов, в том числе ФНО-α, интерферона-g, интерлейкинов 12, 17, 22, 23, и хемокинов (CXCL9, CXCL10 и CCL4). Таким образом, апремиласт действует на начальном этапе воспалительного каскада и регулирует продукцию многочисленных компонентов воспалительного ответа [9].
В Российской Федерации апремиласт в дозе 30 мг два раза в день зарегистрирован под торговым названием ОТЕСЛА® для лечения активного ПсА у взрослых в виде монотерапии или в комбинации с БПВП при недостаточном ответе или при непереносимости предшествующей терапии БПВП, а также для лечения средне-тяжелого и тяжелого бляшечного псориаза у взрослых при недостаточном ответе, наличии противопоказаний или непереносимости других БПВП, включая циклоспорин, метотрексат или лекарственные средства, применяемые вместе с ультрафиолетовым-А облучением. Апремиласт был включен в Российские федеральные рекомендации, рекомендации EULAR (European League Against Rheumatism), GRAPPA (Group for Research and Assessment of Psoriasis and Psoriatic Arthritis), NICE (National Institute for Health and Care Excellence) для лечения пациентов с активным ПсА и псориазом [10-13].
Эффективность апремиласта в лечении псориатического артрита и псориаза
Эффективность и безопасность апремиласта в лечении ПсА изучались в рандомизированных, плацебо-контролируемых клинических исследованиях 3 фазы (программа PALACE), которые проводились по сходным протоколам [14-16]. В целом в эти исследования были включены более 2000 взрослых больных активным ПсА (по крайней мере 3 опухших и болезненных сустава, длительность артрита ≥3 или ≥6 месяцев), которые получали апремиласт в дозах 20 или 30 мг два раза в день или плацебо. В исследования PALACE 1, PALACE 2 и PALACE 3 включали больных, которые ранее принимали стандартные БПВП (72-83% пациентов) или ГИБП (15-28%). Допол ни тель ным критерием включения в исследование PALACE 3 было наличие по крайней мере одной псориатической бляшки размером ≥2 см. Во время исследований допускалась сопутствующая терапия метотрексатом, сульфасалазином, лефлуномидом, глюкокортикостероидами в низких дозах и/или нестероидными противовоспалительными препаратами. Первичной конечной точкой исследований PALACE была частота ответа по критериям Амери канской коллегии ревматологов (АКР 20) через 16 недель, а основной вторичной конечной точкой – изменение индекса нетрудоспособности по вопроснику Health Assessment Questionnaire (HAQ-DI).
По частоте ответа по критерию АКР 20 апремиласт превосходил плацебо как у больных, получавших БПВП (32-41% и 18-19%, соответственно), так и пациентов, которые ранее не принимали БПВП или ГИБП (31% и 16%). К настоящему времени опубликованы результаты долгосрочной терапии апремиластом. Так, через 1 год применения препарата ответ по AКР 20 наблюдался у 61,3% пациентов, через 4 года – у 66,4% [17]. Таким образом, с течением времени отмечалось постепенное стабильное нарастание терапевтического эффекта (рис. 1).
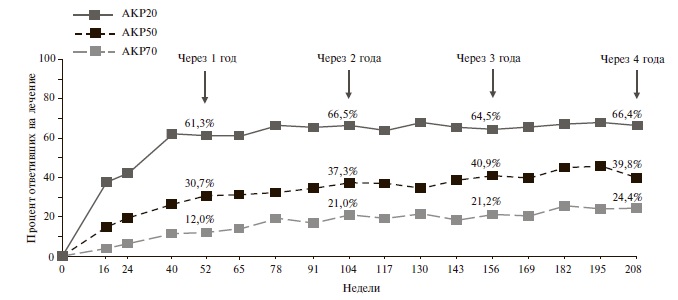 Рис. 1. Частота ответа по критериям АКР при длительном лечении апремиластом у больных ПсА
Рис. 1. Частота ответа по критериям АКР при длительном лечении апремиластом у больных ПсА
Эффективность апремиласта была подтверждена и при анализе динамики индекса HAQ-DI, который в большей степени снизился при применении исследуемого препарата. Клинически значимое снижение индекса HAQ-DI по крайней мере на 0,35 через 156 недель было достигнуто у 48% больных в исследованиях PALACE 1, 2 и 3. Стоит также отметить, что по данным мета-анализа исследований PALACE 1, 2 и 3, у больных, завершивших 52- и 104-недельную терапию апремиластом, отмечалось снижение индекса утомляемости (FACIT-F) на 4,8 и 5,6 балла, соответственно, а клинически значимое снижение этого показателя в обеих точ ках было достигнуто примерно у половины пациентов.
Во всех трех исследованиях лечение апремиластом привело также к достоверному уменьшению числа болезненных и припухших суставов, индекса DAS28СРБ, а также к уменьшению проявлений энтезитов и дактилитов. По данным анализа исследований PALACE 1, 2 и 3, через 3 года применения апремиласта симптомы дактилита были полностью устранены у 79,6% пациентов, симптомы энтезита – у 55,0% (рис. 2, 3).
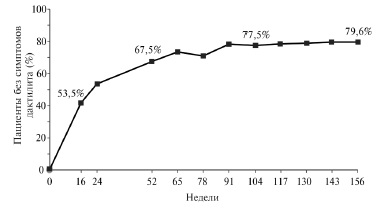 Рис. 2. Динамика процента больных, у которых отсутствовали признаки энтезита, при длительном лечении апремиластом в дозе 30 мг два раза в день
Рис. 2. Динамика процента больных, у которых отсутствовали признаки энтезита, при длительном лечении апремиластом в дозе 30 мг два раза в день
Эффективность апремиласта была подтверждена в рандомизированном, двойном слепом, международном исследовании ACTIVE, в которое были включены 219 пациентов с активным ПсА (по крайней мере три болезненных сустава и по крайней мере три припухших сустава) длительностью ≥3 мес [18]. Больные ранее не получали ГИБП, а стандартные БПВП отменяли перед началом исследования, во время которого допускалась только сопутствующая терапия пероральными глюкокортикостероидами в стабильных низких дозах и/или НПВП. Пациентов рандомизировали на группы апремиласта в дозе 30 мг два раза в день или плацебо. Через 16 недель больных, у которых счет болезненных и при суставов не улучшался по крайней мере на 10%, переводили на апремиласт, а через 24 недели исследуемый препарат назначали всем оставшимся пациентам группы плацебо.
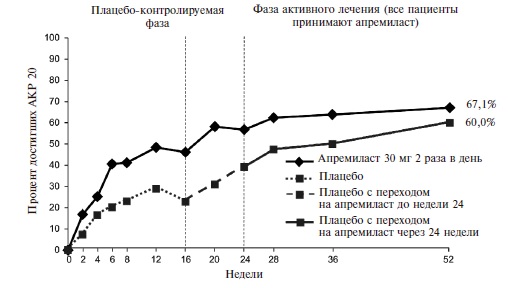 Рис. 3. Динамика процента больных, у которых отсутствовали признаки дактилита, при длительном лечении апремиластом в дозе 30 мг два раза в день.
Рис. 3. Динамика процента больных, у которых отсутствовали признаки дактилита, при длительном лечении апремиластом в дозе 30 мг два раза в день.
Действие монотерапии апремиластом проявлялось быстро. Уже через 2 недели частота ответа по критерию АКР 20 в основной группе достоверно превышала таковую в группе плацебо (16,4% и 6,4%, соответственно; p=0,0252) (рис. 4). При продолжении лечения частота ответа постепенно нарастала и через 16 недель (первичная конечная точка) достигла 38,2% против 20,2% в группе плацебо (p<0,01).
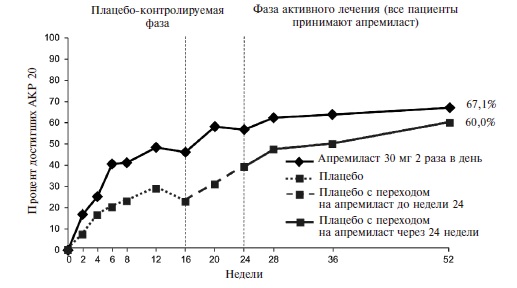 Рис. 4. Частота ответа покритериям АКР20 у больных ПсА в исследовании ACTIVE
Рис. 4. Частота ответа покритериям АКР20 у больных ПсА в исследовании ACTIVE
Достигнутый эффект сохранялся в отдаленном периоде. Через 52 недели частота ответа по критерию АКР 20 у больных, продолжавших прием апремиласта (n=171), составила 63,3%. Достоверное преимущество апремиласта перед плацебо было выявлено и при анализе снижения индекса HAQ-DI как через 2 недели (на 0,13 и 0,05, соответственно; p<0,05), так через 16 недель (на 0,21 и 0,06; p<0,05). Лечение апремиластом по сравнению с плацебо привело также к достоверному снижению индекса DAS28-CРБ (p<<0,05) через 2 и 16 недель (табл. 1).
| Показатели | Исходно | 2 нед | 16 нед | 52 нед |
|---|---|---|---|---|
| Частота ответа по АКР20, | – | 16,4 | 38,2 | 67,1 |
| DAS-28 (СРБ) | 4,81 | -0,59 | -1,07 | -1,71 |
| Выраженность энтезита (GEI: 0-6 | 2,30 | -1,10 | -1,50 | -1,60 |
| Функциональные нарушения (HAQ-DI: 0-3) | 1,25 | -0,13 | -0,21 | -0,40 |
Таким образом, результаты двойных слепых, контролируемых исследований 3 фазы показали, что апремиласт в дозе 30 мг два раза в день по эффективности превосходит плацебо у больных ПсА. Действие препарата проявлялось уже в первые 2 недели, а через 16 недель доля пациентов, ответивших на лечение (АКР 20), составляла 30-40% и достоверно превышала таковую в группе плацебо. Через 3-4 года ответ по критерию АКР 20 наблюдался примерно у 2/3 больных ПсА, продолжавших терапию апремиластом.
Эффективность апремиласта у пациентов со среднетяжелым и тяжелым псориазом изучалась в регистрационных, рандомизированных, двойных слепых, плацебо-контролируемых исследованиях 3 фазы ESTEEM [19,20]. В эти исследования были включены взрослые больные средне-тяжелым или тяжелым бляшечным псориазом кожи (индекс PASI≥12), нуждавшиеся в системной терапии или фототерапии.
Первые результаты лечения отмечались уже через 2 недели применения препарата, а через 16 недель исходное значение индекса PASI уменьшилось по крайней мере на 75% (PASI 75) у трети пациентов. Через 52 недели достигнутый ответ на лечение сохранялся у пациентов, продолживших прием апремиласта.
Особый интерес представляют данные субанализа исследований, отражающие терапевтическую эффективность препарата в отношении проявлений псориаза ногтей и волосистой части головы, которые, в целом, хуже поддаются лечению [21]. В исследовании ESTEEM через 16, 32 и 52 недели индекс NAPSI, который используется для оценки тяжести поражения ногтей, уменьшился на 22,5%, 43,6% и 60,2%, соответственно, а в исследовании ESTEEM 2 – на 29,0%, 60,0% и 59,7%. При этом индекс NAPSI в те же сроки уменьшился по крайней мере в два раза у 33,3%, 45,2% и 63,0% больных, соответственно, в первом исследовании и у 44,6%, 55,4% и 68,6% пациентов во втором исследовании.
Эффективность апремиласта была показана и при анализе динамики поражения волосистой части головы. Так, через 52 недели полное или практически полное разрешение псориаза этой локализации быдо достигнуто у 73,0% пациентов в исследовании ESTEEM 1 и у 62,5% больных в исследовании ESTEEM 2.
Профиль безопасности апремиласта у больных ПсА и псориазом
Отличительной особенностью апремиласта являются хорошая переносимость и благоприятный профиль безопасности [22,23]. При длительном лечении апремиластом у больных псориазом и ПсА не было выявлено увеличения риска серьезных инфекций, сердечно-сосудистых исходов или злокачественных опухолей, частота которых оставалась очень низкой [7]. Также не было выявлено ни одного случая реактивации латентного туберкулеза.
Все ГИБП представляют собой белки, которые обладают иммуногенностью и вызывают образование антител, в том числе с нейтрализующей активностью. Появление нейтрализующих антител при введении ГИБП может нивелировать эффект лечения. По данным мета-анализа 68 исследований более чем у 14000 пациентов с различными аутоиммунными заболеваниями, получавших ингибиторы ФНО-α, частота образования антител к препаратам этой группы составила в целом 12,7%, а при применении инфликсимаба достигла 25,3% [24]. Риск формирования антительного ответа был ниже при применении ГИБП, представляющих собой человеческие антитела, таких как секукинумаб или устекинумаб. Апремиласт – это низкомолекулярный непептидный препарат, поэтому он не способен вызывать появление антител.
В клинических исследованиях основными нежелательными эффектами препарата были легкие или умеренно выраженные желудочно-кишечные нарушения, в том числе диарея, тошнота и рвота, которые возникали в течение первых 2 недель и проходили в течение 4 недель [25]. У большинства больных желудочно-кишечные расстройства не требовали прекращения приема апремиласта. Кроме того, при лечении апремиластом встречались инфекции верхних дыхательных путей и головная боль, в том числе напряжения [7]. При более длительном применении апремиласта (до 156 недель в исследованиях ESTEEM и до 208 недель в исследованиях PALACE) частота и тяжесть нежелательных явлений не нарастали, а новых значимых нежелательных реакций выявлено не было [26,27].
В клинических исследованиях у больных псориазом и ПсА частота депрессии при лечении апремиластом была несколько выше, чем при приеме плацебо. У пациентов с псориазом депрессия ни в одном случае не потребовала прекращения лечения, в то время как у больных ПсА частота отмены апремиласта из-за депрессии составила 0,2% (3 из 1945 пациентов). Псориаз сам по себе ассоциируется с депрессией. Соот ветственно, депрессивное состояние не является основанием для отказа от лечения, однако в таких случаях следует соблюдать осторожность.
У пациентов с легким или умеренным нарушением функции почек апремиласт применяют в стандартной дозе, в то время как при тяжелой почечной недостаточности (клиренс креатинина <30 мл/мин) дозу снижают до 30 мг один раз в сутки. При нарушении функции печени дозу апремиласта менять не следует.
Заключение
Апремиласт – это таблетированный препарат, который действует на более раннем этапе воспалительного каскада, чем ГИБП, в том числе ингибиторы ФНО-α, ИЛ12/23 и ИЛ-17А, и вызывает подавление продукции различных медиаторов воспаления. Апремиласт применяют в дозе 30 мг два раза в день для лечения ПсА у взрослых в виде монотерапии или в комбинации с БПВП при недостаточном ответе или при непереносимости предшествующей терапии БПВП, а также для лечения средне-тяжелого и тяжелого бляшечного псориаза у взрослых при недостаточном ответе, наличии противопоказаний или непереносимости других БПВП, включая циклоспорин, метотрексат или лекарственные средства, применяемые вместе с ультрафиолетовым-А облучением.
В рандомизированных, двойных слепых клинических исследованиях 3 фазы у больных средне-тяжелым и тяжелым бляшечным псориазом и ПсА апремиласт по эффективности достоверно превосходил плацебо, а достигнутый ответ сохранялся в отдаленном периоде. Терапия апремиластом вызывала уменьшение тяжести псориаза ногтей и волосистой части головы, который в целом хуже поддается лечению, а также улучшала качество жизни пациентов с псориазом.
У пациентов с активным ПсА апремиласт оказывал быстрое действие и уменьшал симптомы артрита, энтезита и дактилита. Судить о сравнительной эффективности апремиласта и ГИБП сложно, учитывая отсутствие прямых сравнительных исследований. Преимуществом апремиласта являются возможность приема внутрь и благоприятный профиль безопасности. Лечение этим препаратом не сопровождается повышением риска инфекционных осложнений, в том числе активации латентного туберкулеза, и образованием антител.
Используемые источники
- Nestle FO, Kaplan DH, Barker J. Psoriasis. N Engl J Med 2009;361(12):496-509.
- Круглова Л.С., Моисеев С.В. Блокада интерлейкина-17 – новые горизонты эффективности и безопасности в лечении псориаза. Клин фармакол тер 2017;26(2):5-12.
- Коротаева Т.В. Псориатический артрит: классификация, клиническая картина, диагностика, лечение. Научно-практическая ревматология 2014;52(6): 650–9.
- Национальное руководство по ревматологии. Под ред. Е.Л. Насонова. М.: ГЭОТАР-Медиа, 2010, 320 с.
- Gossec L, Smolen JS, Ramiro S, et al. European League Against Rheumatism (EULAR) recommendations for the management of psoriatic arthritis with pharmacological therapies: 2015 update. Ann Rheum Dis 2016;75:499–510.
- Coates LC, Kavanaugh A, Mease PJ, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis: treatment recommendations for psoriatic arthritis 2015. Arthritis Rheumatol 2016;68:1060–71.
- Keating GM. Apremilast: a review in psoriasis and psoriatic arthritis. Drugs 2017;77(4):459-72.
- Abdulrahim H, Thistleton S, Adebajo AO, et al. Apremilast: a PDE4 inhibitor for the treatment of psoriatic arthritis. Expert Opin Pharmacother 2015;16(7):1099108.
- Haber SL, Hamilton S, Bank M, et al. Apremilast: a novel drug for treatment of psoriasis and psoriatic arthritis. Ann Pharmacother 2016;50(4):282–90.
- Gossec L, Smolen JS, Ramiro S, et al. European League Against Rheumatism (EULAR) recommendations for the management of psoriatic arthritis with pharmacological therapies: 2015 update. Ann Rheum Dis 2016;75:499–510.
- Coates LC, Kavanaugh A, Mease PJ, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis: treatment recommendations for psoriatic arthritis 2015. Arthritis Rheumatol 2016;68:1060-71.
- Кубанов А.А. Резолюция Совета российских экспертов: “Апремиласт, ингибитор
