Актуальность псориаза научные работы
Автор Предложить Статью На чтение 3 мин. Опубликовано 14.04.2015 09:14
Обновлено 21.11.2016 19:48
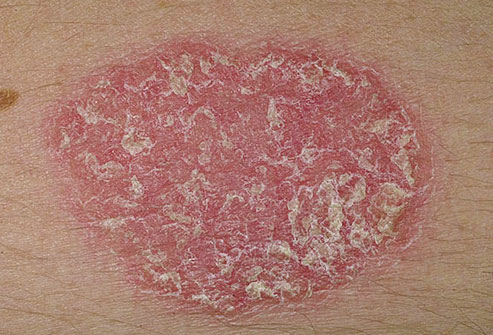
Актуальность проблемы обусловлена значительным ростом заболеваемости псориазом среди населения, лиц работоспособного возраста. Согласно клинико-статистическим данным псориазом страдает от 3 до 7% населения планеты, популяционная частота псориаза в странах Центральной Европы колеблется от 2 до 4,7%. Высок удельный вес псориаза среди других кожных болезней, участились случаи тяжелых форм этого дерматоза, трудно поддающегося лечению и нередко приводящего к инвалидизации.
По Республике Башкортостан в разных районах число больных псориазом колеблется в довольно большом диапазоне: 630 — 640 случаев на 100 тыс. населения в городах, 70 случаев на 100 тыс. населения в сельской местности.
Факторами, провоцирующими развитие псориаза, являются стресс, стрептококковые инфекции, злоупотребление алкоголем, различные физические и химические воздействия на кожу, изменяющие состояние иммунокомпетентных клеток кожи, с участием Т — лимфоцитов, цитокинов, хемотаксических медиаторов и других компонентов, вызывающих формирование псориатического поражения кожи с развитием воспалительной реакции на участках со сниженной резистентностью. Влияние психосоциального стресса связывают с экспрессией кератиноцитов, специфических рецепторов нейропептидов, с гиперпродукцией лейкоцитами ряда цитокинов, а пептидогликаны оболочек некоторых грамположительных бактерий относят к ведущему патогенетическому фактору при инфекционном начале псориаза. Однако многое в этиологии и патогенезе заболевания требует уточнения. На данный момент. преобладает точка зрения, что это системное заболевание организма мультифакториальной природы с участием генетических и средовых факторов.
Псориатический процесс формируется как системное заболевание, при этом нарушения общего метаболизма сочетаются со специфическими изменениями внутритканевой регуляции новообразования, дифференцировки и апоптоза пораженной, кожи, что позволило рассматривать эту патологию как «псориатическую болезнь». Подтверждением важности локальных изменений внутриклеточных регуляторных систем являются и клинические наблюдения того, что отдельные участки кожного покрова даже в период прогрессирования процесса могут длительное время не поражаться. Последние годы проводятся исследования в области генетических и иммунных механизмов нарушений при псориазе. Имеются работы, авторы, которых псориаз относят к обусловленному аутоиммунному заболеванию, однако имеются сообщения о том, что Т-лимфоциты не играют доминирующей роли на клинически манифестной стадии болезни.
В настоящее время повышенное внимание уделяется изучению функционального состояния гепатобилнарной системы. Обращается внимание на существенное повышение смертности от цирроза печени среди больных псориазом. С помощью пункционной биопсии 503 образцов печени у больных псориазом обнаружили в 24% случаев её жировое перерождение, в 1,4% неспецифическое портальное воспаление и только в 1% портальный фиброз.
Многие исследователи отмечают тесную связь между процессами обмена, состоянием кожи и функцией печени. Хронические заболевания печени и ЖВП нередко сочетаются с псориазом и имеют значительный удельный вес в структуре заболеваний лиц наиболее активной возрастной группы.
Источник
Псориаз— аутоиммунное заболевание мультифакториального генеза срецидивирующим течением, многообразием фенотипов, клинических разновидностей ивозможным выявлением различных коморбидностей [1–4]. Поданным литературы, распространенность псориаза вовсем мире составляет 4–7% [5].
По мнению K. Reich, легкие формы заболевания, которые поражают менее 3–5% площади тела и не дают значимых изменений в иммунном статусе больного, требуют только местного лечения. Псориаз среднетяжелого и тяжелого течения является системным, иммуноопосредованным воспалительным процессом, приводящим к развитию сопутствующих патологий или усугубляющим их, а они сами по себе оказывают огромное влияние на здоровье и качество жизни пациента [6–9].
Проблема лечения псориаза не теряет своей актуальности и, несмотря на появление новых современных методов лечения, остается сложной задачей, требующей персонифицированного и, в случае выявления тяжелых коморбидностей, — мультидисциплинарного подхода [10].
Для лечения псориаза существует широкий выбор местных и системных препаратов, большинство из которых обладают иммуномодулирующим эффектом. При выборе персонифицированной терапии учитывается распространенность и степень тяжести псориаза, стадия псориатического процесса, его клиническая форма, а также отношение к болезни самого пациента. Так, при локализации высыпаний на открытых участках кожного покрова — лицо, волосистая часть головы и кисти, болезнь оказывает значительное влияние на качество жизни и вызывает тяжелые психоэмоциональные переживания [11]. По данным исследования G. Krueger и соавт. (2001), 40% больных псориазом были разочарованы неэффективностью получаемого лечения и 32% считали лечение недостаточным [12].
Системная терапия псориаза
Системные глюкокортикоиды в таблетированной форме применяются крайне редко в связи с многочисленными побочными эффектами. Однако в качестве препарата «скорой помощи» для стабилизации псориатического процесса при прогрессирующей стадии, эритродермии целесообразно использование пролонгированных системных глюкокортикоидов для внутримышечного введения в виде коротких курсов. Подобный подход к терапии позволяет избежать неблагоприятных побочных эффектов [2].
Более 40 лет при лечении псориаза применяется метотрексат. Механизм его действия связан с ингибированием дигидрофолатредуктазы, превращающей дигидрофолиевую кислоту в тетрагидрофолиевую и являющейся донором одноуглеродных групп в синтезе пуриновых нуклеотидов и тимидилата, необходимых для синтеза ДНК. В связи с этим одновременное назначение фолиевой кислоты помогает избежать метаболической анемии [13].
Циклоспорин, А — циклический полипептид, выделенный из гриба Tolypocladium inflatum gams, обладает иммуносупрессивным действием посредством подавления активности Т-клеток и снижения их антигенной чувствительности за счет интерлейкинового механизма. Препарат обладает высокой эффективностью при лечении распространенного торпидно протекающего псориаза, псориатической эритродермии [14, 15].
С 1997 г. для лечения рефрактерных форм псориаза используются ароматические ретиноиды второго поколения, основой химической формулы которых является ацитретин. Препарат тормозит пролиферацию клеток эпидермиса, нормализует процесс ороговения, оказывает иммуномодулирующее действие. Эффективность средства зависит от дозы: более высокие дозы приводят к более быстрому разрешению псориатических высыпаний [16].
Относительно недавно появилась новая группа препаратов — биологические препараты, к которым относят рекомбинантные белковые субстанции, синтезированные биотехнологическим путем из живых клеток животных, растений и микроорганизмов. Показанием к назначению биологических препаратов являются тяжелые формы псориаза, резистентные к другим системным препаратам [17, 18].
Лечение среднетяжелых и тяжелых форм псориаза (более 10% поверхности тела) проводят с учетом коморбидных состояний, таких как метаболический синдром, сердечно-сосудистые заболевания, сахарный диабет, неалкогольная жировая болезнь печени, дислипидемия. По данным статистических исследований, подобные коморбидные состояния при псориазе наблюдаются чаще, чем в общей популяции [19]. Таким образом, при лечении псориаза необходимо учитывать риск побочных эффектов от проводимой системной терапии соответственно коморбидным состояниям, выявляемым индивидуально у каждого больного. Действительно, некоторые фармакологические препараты могут негативно повлиять на сердечно-сосудистые и метаболические сопутствующие заболевания. Связь между псориазом и сердечно-метаболическими расстройствами имеет важные клинические последствия. Во-первых, системная терапия псориаза может негативно повлиять на обменные сопутствующие заболевания, особенно в случае непрерывного и длительного лечения. В частности, метотрексат следует назначать с осторожностью при ожирении, сахарном диабете, неалкогольной жировой болезни печени в связи с повышением риска фиброза печени [20]. Циклоспорин, А может вызывать появление или усугубить течение артериальной гипертензии, усиливать инсулинорезистентность и влиять на метаболизм жирных кислот, обладает нефротоксичностью.
Ацитретин также способствует гипертриглицеридемии и/или гиперхолестеринемии [21]. Таким образом, при ведении больных с псориазом необходимо учитывать все данные.
Особое место в лечении псориаза отводится фототерапии. Положительный эффект ультрафиолета на псориатическую кожу связан с избирательным угнетением Т-клеточного звена иммунитета. По данным литературы, выделяют следующие направления действия фототерапии: противовоспалительное, иммуносупрессивное и антипролиферативное [22]. Фотоиммунологическое воздействие связано с глубиной проникновения ультрафиолетовых лучей. УФБ-лучи воздействуют на эпидермальные кератиноциты и клетки Лангерганса, УФА-лучи проникают в более глубокие слои кожи и оказывают действие на дермальные фибробласты, дендритные клетки и клетки иммунной системы. Положительный эффект ультрафиолетового излучения обусловлен апоптозом Т-клеток, снижением количества клеток Лангерганса, изменением продукции цитокинов, факторов роста (EGF, VEGF), молекул адгезии и нейропептидов [2, 23]. Назначение фототерапии целесообразно при распространенном кожном процессе.
При лечении псориаза используется фотохимиотерапия (ПУВА-терапия) — сочетанное применение длинноволновых ультрафиолетовых лучей (УФА) (320–400 нм) и фотосенсибилизатора (8-метоксипсоралена). ПУВА-терапия является одним из наиболее эффективных методов лечения псориаза, ее назначение целесообразно при распространенном вульгарном и экссудативном псориазе, упорном течении заболевания, выраженной инфильтрации. Лечение проводится по методике 3- или 4-разового облучения в неделю, в среднем курс составляет 20–30 процедур [22].
В настоящее время селективная фототерапия, комбинация средневолнового излучения (280–320 нм) уступила свои позиции и назначается все реже для лечения псориаза. Показанием для ее назначения является псориаз, характеризующийся слабоинфильтрированными бляшками.
Узковолновая УФБ-терапия с пиком эмиссии на длине волны 311 нм по высокой терапевтической эффективности сравнима с ПУВА-терапией, но в отличие от нее не требует применения фотосенсибилизатора. Проводится по методике 3-5-разового облучения в неделю курсом 20–30 процедур.
Для лечения ограниченного бляшечного псориаза в стационарной стадии высокоэффективной терапевтической методикой является эксимерный лазер, который позволяет доставлять монохроматический свет высокой интенсивности длиной волны 308 нм только на пораженный участок кожного покрова [2, 22, 23].
Местная терапия
Достаточно большой выбор местных средств для лечения псориаза включает, в частности, традиционные мази, содержащие деготь, нафталан, ихтиол и салициловую кислоту.
При выборе топической терапии важен индивидуальный подход, от которого будет зависеть комплаентность больного псориазом. Так, в связи с косметической неприемлемостью лечения 40% пациентов не соблюдают режим назначения [24].
Эффективность топических кортикостероидных препаратов при лечении псориаза основана на выраженном противовоспалительном и иммуномодулирующем действии, связанном с механизмом гормонорецепторного комплекса, который проникает в ядро клетки мишени кожи и увеличивает экспрессию генов, кодирующих синтез пептидов, ингибирующих активность фосфолипазы. Этот механизм приводит к снижению образования медиаторов воспаления из фосфолипидов. Особенно предпочтительны комбинированные кортикостероидные мази и кремы с салициловой кислотой. Местные кортикостероидные препараты не показаны для длительного непрерывного лечения и предполагают комбинированные и ротационные схемы, т. к. длительное применение может привести к развитию побочных эффектов, таких как атрофия кожи, гипертрихоз, телеангиэктазии, стероидные акне и угнетение функции надпочечников [25].
Синтетические аналоги витамина Д3 хорошо зарекомендовали себя в качестве высокоэффективных антипсориатических средств. Наиболее известен из этой группы кальципотриол. Принцип действия препарата основан на кератопластическом эффекте витамина Д3: он тормозит пролиферацию кератиноцитов и моделирует эпидермальную дифференцировку, а также обладает иммуномодулирующим эффектом, в частности уменьшая экспрессию ИЛ-2 и ИНФ-γ [26]. Кальципотриол обладает кумулятивным действием, в связи с чем терапевтический эффект наблюдается через 1–2 нед. от начала лечения.
В отличие от топических стероидов возможно длительное применение данной группы препаратов. Для достижения максимального терапевтического эффекта возможно комбинированное назначение кальципотриола и топических стероидов.
Действие местных ингибиторов кальциневрина (такролимус и пимекролимус) связано с блокированием сигнальной трансдукции Т-лимфоцитов посредством ингибирования кальциневрина. Наиболее целесообразно назначение этой группы препаратов в случае локализации высыпаний на лице, т. к. они не обладают такими побочными эффектами, как топические стероиды [25].
Значение использования эмольянтов, или смягчающих средств, при лечении псориаза не вызывает сомнений: они смягчают кожу, уменьшают шелушение и сухость, усиливают ее гидратацию, особенно после ультрафиолетового воздействия; способствуют уменьшению зуда. Наибольший эффект достигается при нанесении эмольянтов на влажную кожу после контакта с водой (ванна, душ). Использование эмольянтов в комплексной терапии псориаза снижает общую стоимость лечения в результате достижения стабилизации заболевания и наступления ремиссии за более короткие сроки, что способствует сокращению пребывания больных в стационаре [27].
Таким образом, проблема лечения псориаза сохраняет свою актуальность и остается комплексной задачей, направленной в первую очередь на персонифицированный подход к терапии, от которой будет зависеть комплаентность больного псориазом и проспективное ведение пациентов с учетом коморбидности.
Источник
.jpg) Уже стало общепризнанным классифицировать псориаз как аутоиммунное заболевание, характеризующееся хроническим рецидивирующим течением, многообразием клинических форм и коморбидностей и, нередко в связи с этим, малой эффективностью терапии. По многочисленным эпидемиологическим исследованиям, псориазом страдает до 5—7% населения земли с продолжающимся ростом заболеваемости, в том числе его тяжелыми и тор-пидно протекающими фенотипами.
Уже стало общепризнанным классифицировать псориаз как аутоиммунное заболевание, характеризующееся хроническим рецидивирующим течением, многообразием клинических форм и коморбидностей и, нередко в связи с этим, малой эффективностью терапии. По многочисленным эпидемиологическим исследованиям, псориазом страдает до 5—7% населения земли с продолжающимся ростом заболеваемости, в том числе его тяжелыми и тор-пидно протекающими фенотипами.
По данным американских исследователей распределение больных различными формами псориаза по тяжести клинической картины подчиняется правилу «третей» — две трети больных страдают легкими и умеренными по тяжести и течению формами заболевания, а одна треть — среднетяже-лым и тяжелым псориазом [1]. Если общее число больных псориатической болезнью в Европе и США недавно насчитывало около 10 млн человек, то на долю легких форм приходит-ся от 6 до 7,5 млн (3,5 млн в Европе и 3—4 млн в США), а тяжелым псориазом страдают около 3 млн человек (1,6 млн в Европе и 1,5—2 млн в США).
Как известно, принципиальный выбор объема терапии больного псориазом зависит от тяжести проявлений заболевания — при тяжелом псориазе проводят системную терапию, для легких и средней тяжести форм можно ограничиться местными терапевтическими средствами.
В последние 5—10 лет во многих медицинских дисциплинах стали применяться новые терапевтические концептуальные подходы — строго направленное целевое лечение, как можно раннее вмешательство и формулирование достижимых конечных целей лечения. Недавно группа экспертов из 19 стран Европы предложила включить в обновленные рекомендации по лечению псориаза три главных принципа успешной целенаправленной терапии, которые включают строгое соблюдение терапевтических алгоритмов, регулярное отслеживание терапевтического ответа и своевременную модификацию лечения, если терапевтические цели не дости-Уже стало общепризнанным классифицировать псориаз как аутоиммунное заболевание, характеризующееся хроническим рецидивирующим течением, многообразием клинических форм и коморбидностей и, нередко в связи с этим, малой эффективностью терапии. По многочисленным эпидемиологическим исследованиям, псориазом страдает до 5—7% населения земли с продолжающимся ростом заболеваемости, в том числе его тяжелыми и тор-пидно протекающими фенотипами.
По данным американских исследователей распределение больных различными формами псориаза по тяжести клинической картины подчиняется правилу «третей» — две трети больных страдают легкими и умеренными по тяжести и течению формами заболевания, а одна треть — среднетяже-лым и тяжелым псориазом [1]. Если общее число больных псориатической болезнью в Европе и США недавно насчитывало около 10 млн человек, то на долю легких форм приходится от 6 до 7,5 млн (3,5 млн в Европе и 3—4 млн в США), а тяжелым псориазом страдают около 3 млн человек (1,6 млн в Европе и 1,5—2 млн в США).
Как известно, принципиальный выбор объема терапии больного псориазом зависит от тяжести проявлений заболевания — при тяжелом псориазе проводят системную терапию, для легких и средней тяжести форм можно ограничиться местными терапевтическими средствами.
В последние 5—10 лет во многих медицинских дисциплинах стали применяться новые терапевтические концептуальные подходы — строго направленное целевое лечение, как можно раннее вмешательство и формулирование достижимых конечных целей лечения. Недавно группа экспертов из 19 стран Европы предложила включить в обновленные рекомендации по лечению псориаза три главных принципа успешной целенаправленной терапии, которые включают строгое соблюдение терапевтических алгоритмов, регулярное отслеживание терапевтического ответа и своевременную модификацию лечения, если терапевтические цели не достигаются [2]. При псориазе основными оценочными критериями достижения целей терапии по-прежнему остается динамика таких показателей, как Psoriasis Area and Severity Index (PASI) и дерматологического индекса качества жизни (ДИКЖ). Таким образом, целевая ориентация терапевтических подходов становится необходимым компонентом консенсусных рекомендаций по лечению псориаза.
Существенное влияние на тактический выбор терапии при псориазе оказывают различные коморбид-ности, которым уделяется большое исследовательское внимание. Сегодня становится все более понятным и убедительным, что псориаз это не просто кожное заболевание. Последнее время многими исследованиями показано существование биомаркеров, доказывающих системный характер псориаза в виде таких коморбидных процессов, как болезнь Крона и ревматоидный артрит. Особую озабоченность вызывают данные, указывающие на тесную связь псориаза с сердечнососудистыми заболеваниями, повышающими смертность от них среди больных псориазом. Некоторые авторы склонны рассматривать причинные связи между псориазом и сердечнососудистыми заболеваниями в качестве «псориатического марша», что представляет большой практический и академический интерес и несомненно требует дополнительных доказательных исследований [3].
В результате одного рандомизированного обследования 6549 американцев в возрасте от 20 до 59 лет была оценена частота метаболического синдрома в зависимости от возраста, пола, этнической принадлежности, табакокурения и уровня С-реактивного белка. Оказалось, что метаболический синдром встречается у 40% больных псориазом (против 23% среди здоровых), насчитывая около 2,7 млн таких коморбидных больных американцев. Самыми частыми признаками метаболического синдрома у больных псориазом были ожирение в области живота, гипертриглицеридемия и низкий уровень липопротеинового холе-стерола. Полученные данные говорят о необходимости более ответственного отношения к диагностике метаболического синдрома у больных псориазом, особенно при организации длительной антипсориатической терапии [4]. При этом результаты такого подхода иногда могут оказаться неожиданными. Так, в результате метаанализа исследований по выявлению влияния усте-кинумаба при псориазе на риск развития сердечно-сосудистых побочных эффектов как коморбидных состояний оказалось, что частота инфарктов миокарда, стенокардий и смертей от сердечно-сосудистых заболеваний у больных псориазом, находившихся на лечении устекинумабом, не превышает таковую как в общей популяции американцев, так и в контрольной группе больных псориазом [5].
Согласно международным и отечественным рекомендациям основными системными терапевтическими средствами при тяжелом псориазе являются биологические препараты, синтетические ретиноиды, метотрексат и циклоспорин А. Как показано в последнее время, патогенез псориаза, как и некоторых других аутоиммунных заболеваний, связан с активностью IL-23 как ведущего регулятора Th17, играющих наиважнейшую роль в кожном иммунном воспалении путем выработки IL-17 и других провоспалительных цитоки-нов. В 2009 году Европейским медицинским агентством и Американским FDA было разрешено применение при тяжелом псориазе нового биологического препарата устекинумаб (CNTO-1275), который специфически блокирует IL-12 и IL-23 путем связывания общей для обоих интерлейкинов субъединицы p40. Устекинумаб представляет собой человеческие монокло-нальные антитела класса IgG (1), обладающие низкой иммуногенностью. Применение препарата в виде подкожных инъекций в дозе 45 мг на 0-й, 4-й и затем каждой 12-й неделе приводит к 75% редукции исходного уровня PASI у 66,4—75,7% больных после 12 недель лечения и практически к абсолютной редукции показателя ДИКЖ у 55—56%. Самые последние исследования показывают высокую эффективность устекинумаба и у больных псориати-ческим артритом. Серьезные побочные эффекты у больных, получавших устекинумаб, зарегистрированы в 1,4—1,6% по сравнению с 1,4% в группе плацебо. Нежелательные реакции в местах инъекций имели место у 1—2% больных, и выработка антител против устекинумаба установлена у 5% пациентов. Продолжаются исследования по эффективности и безопасности устекинумаба при его длительном применении [6—8].
Во многих странах мира свою нишу в лечении части больных псориазом прочно занял циклоспорин А. Он показан для больных бляшеч-ным, пустулезным и эритродермиче-ским псориазом при стартовой дозе 5 мг/кг/день. Наилучшее соотношение эффективности и безопасности имеет место у больных без факторов риска для нефротоксичности, т. е. без ожирения, без гипертонии и в возрасте до 60 лет. Циклоспорин А лучше всего подходит для «кризисной» терапии на протяжении 6—8 недель, однако у части больных может применяться длительно в качестве поддерживающей терапии при условии постоянного мониторинга сывороточного креати-нина, но не более двух лет [9].
Что касается метотрексата, то он по праву доступного и достаточно эффективного средства может быть признан препаратом первой линии при среднетяжелом и тяжелом псориазе. Согласно большинству рекомендаций начальная доза метотрексата составляет 5—10 мг/нед предпочтительно в виде перорального приема, а при плохой переносимости — подкожное введение в той же дозе. При слабом терапевтическом ответе доза увеличивается до 15—25 мг/нед. Лечение метотрекса-том должно сопровождаться фолиевой кислотой. Существующие последние исследования не подтверждают риска развития фиброза печени на фоне лечения метотрексатом [10].
По данным доказательной медицины к эффективным наружным средствам при псориазе относятся дегтярные препараты, кортикостероиды, аналоги витамина D3 и ретиноиды. Самыми часто назначаемыми среди них следует признать наружные кортикостероиды и аналоги витамина D3.
Разнообразные кортикостероиды при наружном применении в многочисленных доказательных исследованиях и в клинической практике давно стали самыми популярными и демонстрируют свою высокую эффективность при бляшечном псориазе, приводя к полному регрессу высыпаний в течение первых 2—3 недель применения. Однако наступающая ремиссии обычно кратковременна, длительная терапия приводит к привыканию и стероидной резистентности, а известный набор прогнозируемых побочных эффектов ограничивает длительное применение особенно мощных корти-костероидов.
Аналоги витамина D3 (кальципотри-ол) обладают постепенно нарастающей (4—8 недель при 2-кратном нанесении в день), но стойкой клинической эффективностью, изредка возникающим раздражением кожи и возможным нарушением метаболизма кальция при использовании чрезмерно больших количеств препарата (более 100 г в неделю).
Особый интерес в этом наборе наружных антипсориатических средств представляет комбинация кальципотриола и бетаметазона (Дайвобет), эффективность которой обусловлена синергич-ным действием ее компонентов на пролиферацию и дифференцировку кера-тиноцитов и на иммунное воспаление в коже при псориазе. Используемый в качестве основы 5% стеариловый эфир 15-полиоксипропилена обеспечивает оптимальную доставку активных компонентов в кожу. В этой основе хорошо растворяются как кальципо-триол, так и бетаметазон. Она повышает проницаемость кожи для действующих веществ и гарантирует их высокую устойчивость [11].
В препарате содержится 0,005% кальципотриола и 0,05% бетаметазона, которые благодаря уникальной технологии производства характеризуются оптимальной биодоступностью, и комбинированный препарат Дайвобет, таким образом, действует эффективнее, чем каждое из содержащихся в нем активных веществ в отдельности, что было доказано, в частности, в большом сравнительном исследовании с участием 1603 больных псориазом [12]. При этом Дайвобет является единственным препаратом, содержащим сильный кортикостероид, безопасность которого при длительном применении повторными курсами на протяжении года была документально доказана [13]. Достигнутая в этом исследовании более чем 70% редукция индекса PASI после четырехнедельного применения Дайвобета один раз в день сохранялась на протяжении 52 недель на фоне применения препарата по необходимости короткими интермиттирующими курсами.
Кальципотриол и бетаметазон, входящие в состав Дайвобета, значительно расширяют возможности наружного лечения больных псориазом, так как эти компоненты эффективны при всех стадиях болезни, начиная с прогрессирующей. Применение Дайвобета длительно прерывистыми курсами один раз в день значительно повышает ком-плаентность и приверженность больных к лечению.
Российскими дерматологами накоплен большой опыт применения Дайвобета при бляшечном псориазе [14—17]. В этих исследованиях при монотерапии Дайвобетом было показано, что положительная динамика в проявлениях псориаза отмечалась уже на 3-й день терапии, а отчетливый клинический эффект в большинстве случаев наблюдался через 7—10 дней от начала лечения. Наконец, на 10—14 день лечения у большинства пациентов развивался полный регресс мелких элементов и значительное уплощение крупных очагов и интенсивности шелушения. К концу 3—4 недели терапии индекс PASI редуцировал на 60—80%.
Переносимость Дайвобета самими больными оценивается как хорошая и очень хорошая. Каких-либо значимых побочных эффектов и осложнений в ходе его применения, равно как и изменений в лабораторных показателях крови и мочи, не выявляется. Все пациенты отмечают удобство использования препарата.
Имеются также сообщения об успешном применении Дайвобета в комплексе с другими видами, в частности системной терапии псориаза [18, 19]. Было показано, что комбинированное применение блокаторов факторов некроза опухоли альфа, в частности адалимумаба, с Дайвобетом значительно быстрее приводило к регрессу псориатических высыпаний, особенно на первых неделях лечения, по сравнению с монотерапией адалимумабом.
Все это в целом позволяет говорить о том, что комбинированный препарат Дайвобет является высокоэффективным наружным антипсориатиче-ским средством, быстро приводящим к регрессу высыпаний, обладающим высокой комплаентностью и безопасностью при длительном применении. Его можно с успехом комбинировать с системными видами лечения псориаза и применять в амбулаторных условиях. Клинический эффект наружной терапии препаратом Дайвобет оценивается пациентами как стабилизирующий, поддерживающий ремиссию и предотвращающий наступление обострений.
Литература
- Horn E. NPF USA, 2007.
- Mrowietz U, Kragballe K, Nast A., Reich K. Strategies for improving the quality of care in psoriasis with the use of treatment goals-a report on an implementation meeting // J Eur Acad Dermatol Venereol. 2011, May; 25, Suppl 3: 1—13.
- Boehncke W. H, Boehncke S. Tobin A. M, Kirby B. The ‘psoriatic march’: a concept of how severe psoriasis may drive cardiovascular comorbidity // Exp Dermatol. 2011, Apr; 20 (4): 303—307.
- Love T. J, Qureshi A. A., Karlson E. W. et al. Prevalence of the metabolic syndrome in psoriasis: results from the national health and nutrition examination survey, 2003—2006 // Arch Dermatol. 2011, Apr; 147 (4): 419— 424.
- Reich K., Langley R. G., Lebwohl M. et al. Cardiovascular safety of ustekinumab in patients with moderate to severe psoriasis: results of integrated analyses of data from phase II and III clinical studies//Br J Dermatol. 2011, Apr; 164 (4): 862—872
- Kurzeja M, Rudnicka L, Olszewska M. New interleukin-23 pathway inhibitors in dermatology: ustekinumab, briakinumab, and secukinumab // Am J Clin Dermatol. 2011, Apr 1; 12 (2): 113—125.
- Laws P. M, Warren R. B. Ustekinumab for the treatment of psoriasis // Expert Rev Clin Immunol. 2011, Mar; 7 (2): 155—64.
- Yeilding N, Szapary P., Brodmerkel C. et al. Development of the IL-12/23 antagonist ustekinumab in psoriasis: past, present, and future perspectives // Ann N Y Acad Sci. 2011, Mar; 1222 (1): 30—39.
- Maza A., Montaudie H, Sbidian E. et al. Oral cyclosporin in psoriasis: a systematic review on treatment modalities, risk of kidney toxicity and evidence for use in non-plaque psoriasis // Journal of the European Academy of Dermatology and Venereology. P. 19—27.
- Montaudie H., Sbidian E., Paul C. et al. Methotrexate in psoriasis: a systematic review of treatment modalities, incidence, risk factors and monitoring of liver toxicity // Journal of the European Academy of Dermatology and Venereology. 2011, May, v. 25, 12—18.
- Ruzicka T., Lorenz B. Comparison of calcipotriol monotherapy and a combination of calcipotriol and betamethasone valerate after 2 weeks’ treatment with calcipotriol in the topical therapy of psoriasis vulgaris: a multicentre, double-blind, randomized study // Br J Dermatol. 1998, v. 138, p. 254—258.
- Kaufmann R, Bibby A. J., Bissonnette R. et al. A new calcipotriol/betamethasone dipropionate formulation (Daivobet) is an effective once-daily treatment for psoriasis vulgaris // Dermatology. 2002; 205: 389—393.
- Kragballe K., Noerrelund K. L., Lui H. et al. Efficacy of once-daily treatment regimens with calcipotriol/betamethasone dipropionate ointment and calcipotr ol ointment in psoriasis vulgaris // Br J Dermatol. 2004; 150: 1167—73. Br J Dermatol. 2006, v. 155, p. 737—741.
- Филимонкова Н. Н, Кащеева Я. В, Чуверова К. А. Клинический эффект последовательного назначения препаратов дайвобет и дайвонекс в комплексной терапии больных псориазом // Вестник дерматологии и венерологии. 2006; № 6.
- Короткий Н. Г., Уджуху В. Ю, Кубылинский А. А., Тихомиров А.А. Дайвобет-новый высокоэффективный препарат для наружного лечения больных среднетя-желым и тяжелым вульгарным псориазом // Клиническая дерматология и венерология. 2007; № 4: 64—69.
- Монахов К. Н, Хобейш М. М, Соколовский Е. В. Современные аспекты наружной терапии псориаза // Клиническая дерматология и венерология. 2006; № 2: 47—50.
- Тогоева Л. Ш, Невозинская З. В., Корсунская И. М, Ахмедова П. А. Наружная терапия ограниченных форм псориаза // Клиническая дерматология и венерология. 2008; № 2: 42—44.
- Katsambas A. et al. Improvement in quality of life in patients treated with adalimumab plus adjunctive topical therapy (calcipotriol/betamethasone) for moderate to severe psoriasis: Results of the BELIEVE study. 18 th EADV Congress, 2009, P. 1169.
- Thaci D, Ortonne J. P., Chimenti S. et al. A Phase IIIb, Multi-Centre, Randomized, Double-Blind, Vehicle-Controlled Study of the Efficacy and Safety of Adalimumab With and Without Calcipotriol/Betamethasone Topical Treatment in Patients with Moderate to Severe Psoriasis: The BELIEVE Study // Br J Dermatol. 2010, Apr 2. [Epub ahead of print]).
Н. Г. Кочергин, доктор медицинских наук, профессор
Л. М. Смирнова, кандидат медицинских наук
Первый МГМУ им. И. М. Сеченова, Москва
Контактная информация об авторах для переписки: nkocha@yandex.ru
Источник
